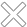Anzahl klinischer Studien und Neuzulassungen
Daten & Fakten der pharmazeutischen Industrie
Neue potenzielle Wirkstoffe werden zunächst in präklinischen Studien (z.B. an Zellkulturen oder anderen biologischen Modellen) identifiziert und charakterisiert. Um als Arzneimittel für die klinische Routine eine Zulassung zu erhalten, müssen diese zuerst mehrere Phasen von klinischen Studien an PatientInnen durchlaufen. Deren Ziel ist es, die bestmögliche Ratio von Dosis, Wirksamkeit und Verträglichkeit zu evaluieren, um letztlich die Behandlung von PatientInnen mit Krebs zu verbessern. Für die Zulassung eines Arzneimittels relevant sind klinische Prüfungen der Phase I (Dosisfindung), II (frühe Wirksamkeit) und III (Wirksamkeit und Sicherheit in einem großen PatientInnen-Kollektiv). In einer Phase-IV-Studie ist das entsprechende Medikament bereits zugelassen, und es werden weiterführende Daten z.B. zur Langzeitsicherheit in der klinischen Routine erhoben. Im Gegensatz dazu ist eine nicht-interventionelle Studie (NIS, „Anwendungsbeobachtung“) eine systematische Untersuchung zugelassener Arzneimittel an PatientInnen, sofern die Arzneimittel ausschließlich unter den in der Zulassung genannten Bedingungen verwendet werden und keine zusätzlichen diagnostischen oder therapeutischen Maßnahmen notwendig sind.
Neu zugelassene Onkologika in Europa
Von 1995–2020 wurden von der europäischen Arzneimittelagentur EMA (European Medicine Agency) 145 neue medikamentöse Therapien im Bereich der Onkologie zugelassen. Allein 2020 wurden in Europa 21 neue medikamentöse Tumortherapien auf den Markt gebracht, 11 davon mit neuem Wirkstoff.
Anzahl der von der EMA zugelassenen Krebsmedikamente
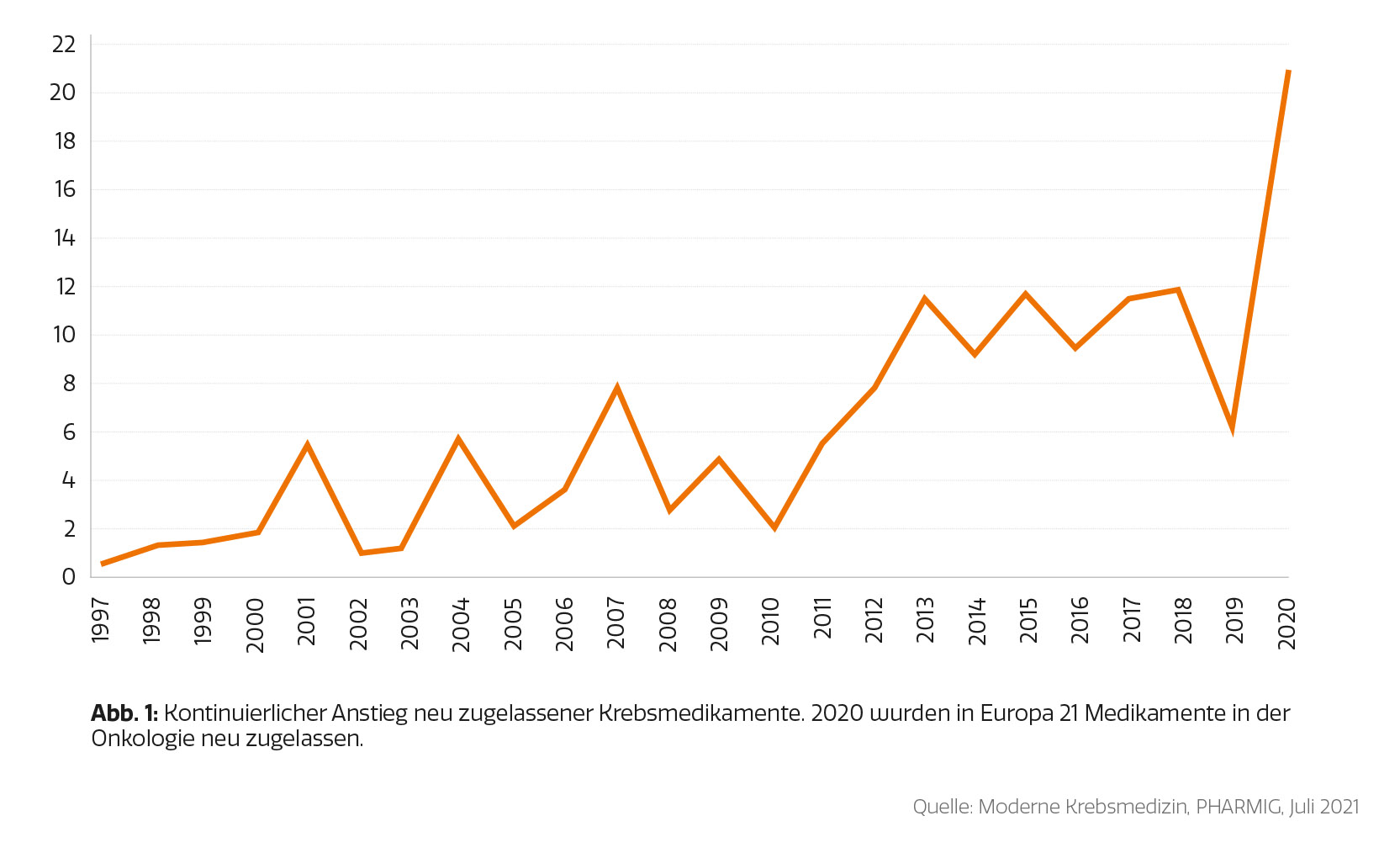
Klinische Studien in Österreich
Die nachfolgenden Daten zu klinischen Studien in Österreich wurden von der PHARMIG (Verband der pharmazeutischen Industrie Österreichs) für den Krebsreport zur Verfügung gestellt. Die PHARMIG führt jährlich eine Umfrage unter den Mitgliedsunternehmen zu Industrie-gesponserter klinischer Forschung in Österreich durch. In den letzten fünf Jahren nahmen jeweils rund 34 Unternehmen an der Umfrage teil. Das entspricht einer Marktabdeckung von ca. 79 %. Da die Teilnahme an der Umfrage freiwillig ist, erheben die Ergebnisse keinen Anspruch auf Vollständigkeit. Erhoben werden Angaben zu laufenden, begonnenen und beendeten klinischen Studien pro Jahr nach Indikationsgebiet inklusive Anzahl der teilnehmenden PatientInnen (Abbildung 2 und 3).
Anzahl laufender klinischer Prüfungen nach Phasen sowie Nicht-interventionelle Studien (NIS) in Österreich 2015–20
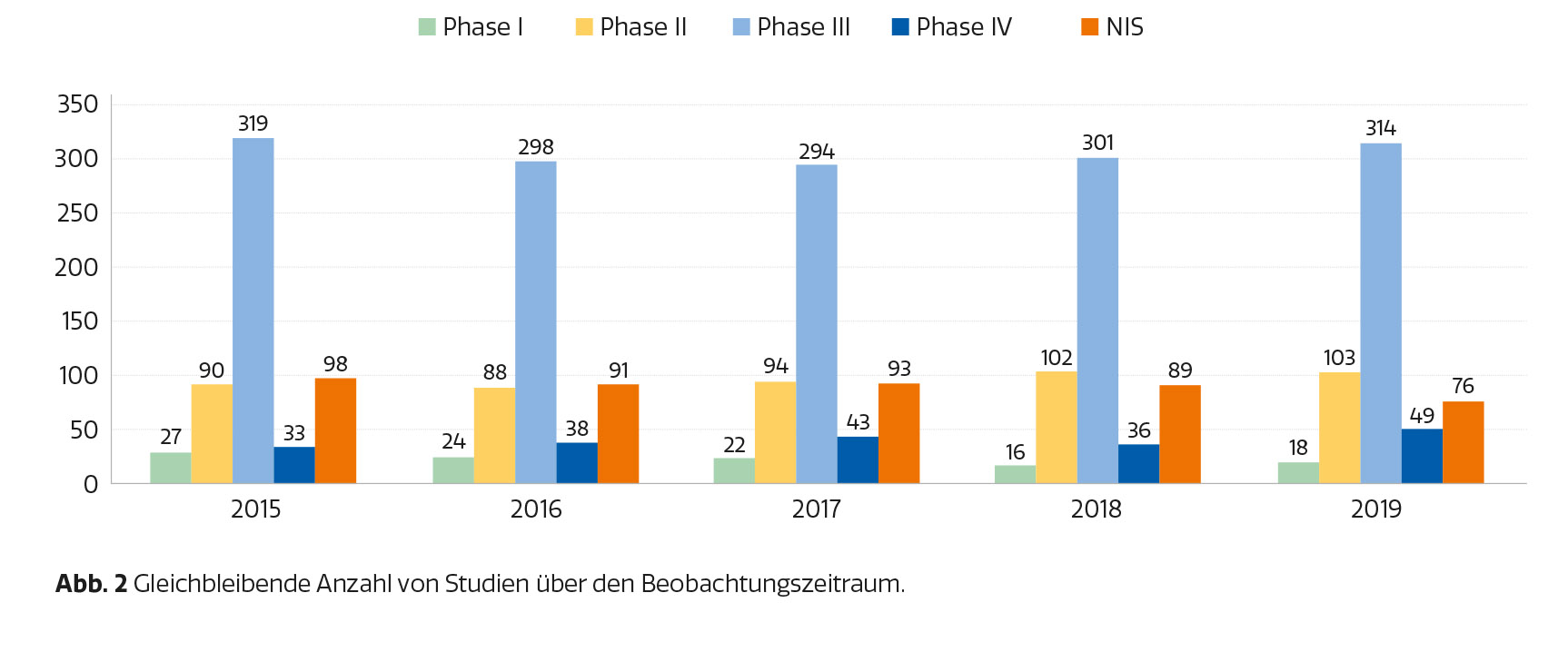
Anzahl der PatientInnen in laufenden klinischen Prüfungen nach Phasen sowie Nicht-Intervenitonelle Studien (NIS) in Österreich 2015–2019
Armin Gerger,
Michael Micksche